Distribucija elektrona u višeelektroničkoj atomu zasniva se na principu najmanje energije, načelo V. Papuli, vladavina F. Hund i pravilo Klekkovskog.
Princip najmanje energije:
Elektron se prvenstveno nalazi unutar elektronskog sublaža sa najnižom energijom.
Prvo, orbitale su popunjene, karakteriziraju najmanju potencijalnu energiju.
Powli princip:
U atomu ne može biti dva elektrona, u kojoj bi svi četiri kvantna broja bila ista.
Shodno tome, svaka orbitarna karakterizirana određenim vrijednostima n, ℓ i m ℓ može zauzeti ne više od dva elektrona čija su leđa imaju suprotne znakove. Takvi se elektroni nazivaju Parsen.
Koristeći princip Pauli, možete izračunati koji maksimalni broj elektrona može biti na svakom nivou i superti, tj. Odredite nivo kapaciteta i podloge.
Broj orbitala na podloge određuje se brojem mogućih vrijednosti magnetskog kvantnog broja, I.E. 2ℓ + 1 vrijednost. Budući da svaki orbitalni (određena vrijednost kvantnog broja N, ℓ i M ℓ) može primiti dvije elektrone s različitim vrijednostima centrifuge, a zatim maksimalni broj elektrona koji se mogu postaviti na ovaj apartman je: 2 (2ℓ + 1). Maksimalni broj elektrona koji mogu biti na dat nivoa karakterizira glavni kvantni broj n, jednak 2N 2.
Hund pravilo:
U najstabilnijem stanju atoma, elektroni se postavljaju unutar elektronskog sublaja, tako da je njihov ukupni spin maksimum. M. je simbol nableronona koji mogu biti na datom nivou, koju karakteriše glavni kvantni broj
Na primjer, atometar azota na vanjskom nivou elektrona je dva i tri p-elektrona. Ovdje su elektroni u orbitalima prikazani strelicama usmjerenim gore ili dolje ovisno o znaku kvantnog broja Spin. S-S-vjernik sadrži jedini orbital na kojem postoje dva elektrona sa suprotnim okretama u skladu s principom Paulia. U skladu s vladavinom Hindije, najmanje energije će imati konfiguraciju A, u kojoj će na svakom od tri p-orbitale biti jedan elektron s istim usmjerenim okretama, tako da će ukupni spin biti maksimiziran (± 3/2) , a ne u kojem se ukupno okreće manje (± 1/2):
Prvo pravilo Clakovsky:
Elektron ima najnižu energiju na elektroničkom podlogu, gdje je zbroj glavnog i orbitalnog kvantnog broja minimalan.
E \u003d min sa N + ℓ \u003d min
U skladu s prvom vladavinom Clekkovskog, punjenje sublajnih elektrona javlja se u redoslijedu sublovača sa minimalnom vrijednošću iznosa (N + ℓ) na sublage u velikim vrijednostima N + ℓ.
Ako je zbroj (N + ℓ) isti za elektronske podmaženja pod razmatranjem, a koristi se raspodjela elektrona drugo pravilo Clakovsky:
Elektron ima najnižu energiju na podloge s najmanom vrijednošću glavnog kvantnog broja.
4.5 Elektronska atomska struktura i periodični sistem elemenata
Na ℓ \u003d 0, i.e. Na S-Supro, postoji samo jedan orbitalni, koji je obično prikazan u obliku ćelije. U N ATOM-u, jedini elektron je na najnižim mogućim energetskim državama, I.E. Na S-supro mehovima prvog elektronskog sloja (na 1S-pion). Elektronska struktura N atoma može se podnijeti shemom:
Na helijumskom atomu, od kojih je slijed broja u periodičnom sustavu (ili nukleusu z) 2, drugi elektron je i u stanju 1S. Elektronska struktura helijum atoma:
Ovaj atom dovršava popunjavanje K-sloja najbliže kernelu i na taj način je izgradnja prvog razdoblja sistema elemenata završena.
Metode opisanih elektronskih školjki koje se razmatraju za atome h i naziva se elektronskim grafičkim formulama (orbitalne slike prikazane su u obliku stanica) i elektronskim formulama (linije su označene slovima, a broj elektrona naznačenim slovima, a broj elektrona naznačenim do gornjeg indeksa).
U sljedećem helijumu litijskog elementa (Z \u003d 3), treći elektron više ne može biti smješten na orbitalnom K-sloju. K-sloj se naziva prvi elektronički sloj atoma: to bi u suprotnosti sa principom Paulia. Stoga zauzima S-stanje drugog nivoa energije (L-sloj. L-sloj se naziva drugi elektronski sloj atoma., N \u003d 2). Njegova elektronička struktura bilježi 1s 2 2s 1 formula. Elektronska struktura sljedećeg berilije i borona slijedi, odgovara formuli 1s 2 2s 2 i 1s 2 2s 2 P 1, što odgovara elektronskim grafičkim formulama u dijagramu:
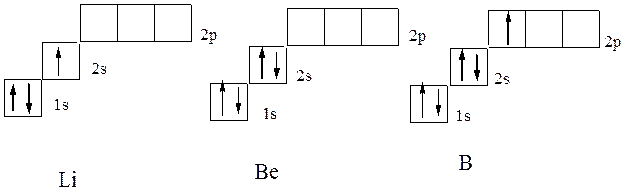
Koristi se skraćeni oblik elektronske strukture atoma. Istovremeno je opisana struktura vanjskih praznih nivoa, a umjesto elektronske strukture unutrašnjih slojeva, simbol inertnog plina označen je u zagradama, od čije elektroničke strukture odgovara preostalom dijelu elektronske formule . Dakle, za elemente drugog perioda, prvi elektronički nivo (n \u003d 1) koji odgovara atomu helijuma u potpunosti je ispunjen. Elektronska formula u skraćenoj verziji atoma: litijum - 2s 1, berilijum verzija atoma litijumskog atoma: Dakle, za elemente drugog perioda, elektronska struktura Koto2s 2, Boron - 2s 2 2p 1.
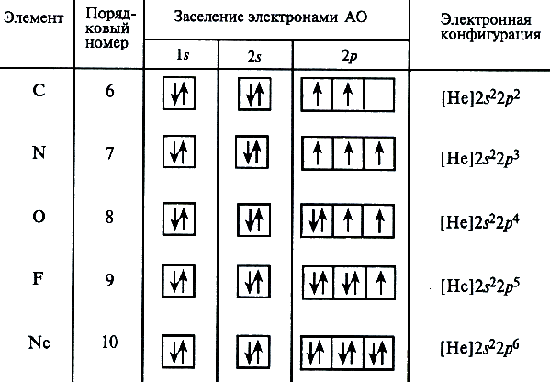
Za ugljični atom, tri moguća šema punjenja elektronskih školjki već se mogu pretpostaviti u skladu s elektronikom i grafičkim formulama:
Analiza atomskog spektra pokazuje da je potonja shema tačna. Ovaj postupak za postavljanje elektrona u ugljikonu predstavlja poseban slučaj općeg obrasca koji je izražen atomskim tečajem: Stabilno stanje atoma odgovara takvoj distribuciji elektrona unutar energetskog sublaga, u kojem apsolutnu vrijednost ukupnog spina atoma je maksimum. Predstavljena je elektronska struktura za atomu azota (Z \u003d 7).
Tada počinju parovi elektrona na 2P orbitalu. Elektronske formule preostalih atoma drugog perioda:
O 1s 2 2s 2 2p 4; F 1s 2 2s 2 2p 5; Ne 1s 2 2s 2 2p 6
Zakon Neo Atom popunjava drugi nivo energije, a izgradnja drugog perioda sistema elemenata je završen.
Treći period, sličan drugom, započinje sa dva elementa (NA, MG), u koji se elektroni postavljaju na S-pionir vanjskog elektronskog sloja. Takvi elementi se nazivaju S-Elementi. Govoreći drugačije, oni pripadaju porodici S-Elements. (I.E. odnose se na S-porodicu elemenata). Tada se slijede šest elemenata (od Al u AR), koji imaju P-subludniku vanjskog elektronskog sloja. To su atomi p-elemenata (pripadaju porodici). Struktura vanjskog elektronskog sloja odgovarajućih elemenata drugog i treća razdoblja je slična. Drugim riječima, s porastom naboja kernela, elektronska struktura vanjskih slojeva atoma se periodično ponavlja. Međutim, elektronska struktura atoma određuje svojstva elemenata i njihovih spojeva. Ovo je suština periodičnog zakona: svojstva elemenata i njih formirane od strane jednostavnih i složenih tvari nalaze se u periodičnoj ovisnosti o naboju kernela.
Argon atom ostaje nezauzet svim orbitalima 3D-podloge. Međutim, sledeći argonski elementi - kalijum i kalcijum - punjenje 3. elektronskog sloja privremeno se zaustavlja, a četvrti sloj S-Su-Suslojnik počinje formirati. Takav redoslijed punjenja slijedi iz prvog pravila Clakovskog. Slijedom toga, 4s-sublayer (N + ℓ \u003d 4) mora biti ispunjena ranije od 3D (N + ℓ \u003d 5). Za Scandium Atom, postavlja se pitanje: koja od podloge treba popuniti - 3D ili 4p, jer Sum N + ℓ je isti za njih i jednaka 5. U takvim slučajevima, nalog za završetak određuje se drugim pravilom. Prvi i drugi Clakovsky pravila često se ne podijele, ali se smatraju jedno zajedničko pravilo pravila Clacckovskog, prema kojima su iste količine iznosa (N + ℓ) popunjeni u cilju povećanja glavnog kvantnog broja n . Ispunjavanje 3D sublajca javlja se u deset elemenata od SC do Zn. Ovo su atomi D-Elements. Tada počinje formiranje 4p-paketa (P-elementi iz GA do KR). Kao i atomi prethodnih plemenitih gasova - Neona i Argona - Crypton Atom karakteriše struktura vanjskog elektronskog sloja NS 2 NP 6.
Peti period formira se slično.
U šestom periodu, nakon punjenja, 6s sublayer započinje punjenje 4F-suite, a atomi F-elemenata se slijede. Zbog činjenice da je njihov vanjski šesti nivo, a elektroni dosljedno zauzimaju četvrti nivo, što je mnogo bliže kernelu, hemijska svojstva svih ovih F-elemenata, tako da su često nazivaju Lanthanoidi ( U 7. period F-elementi se nazivaju aktinoidima). Nakon 4F-a, 5D se popunjava i na kraju, 6p sublajnik, koji dovršava izgradnju šestog razdoblja. Sedmi period nije završen, jer Elementi s velikim nabojem kernela vrlo su nestabilni (nuklearne reakcije lako tekuju).
Redoslijed popunjavanja podloge u skladu s pravilima Clakovsky-a može se napisati kao niz: 1s → 2s → 2p → 3s → 3p → 4s → 5s → 4d → 5p → 6s → 6p → 7s → 5f → 6d → 7p. Međutim, za neke elemente, ovaj niz je slomljen, I.E. Iz pravila Clakovskog postoje izuzeci. U CR, CU, NB, MO, RU, RH, PD, AG, PT, AOM-ovi, postoji "neuspjeh" elektrona s vanjskim slojem S-SUPRO-sloja koji vodi do energije- hvala na većini odgovarajućih u potpunosti (Cu, PD, AG, PT, AU) ili polovina (CR, MO) ispunjena D-subframeom. Na primjer, elektronska formula bakra Atoma ima oblik: CU 1S 2 2s 2 2p 6 3s 2 3p 6 3D 10 4s 1, I.E. Jedan od dva 4S elektrona "ne uspijeva" na 3D-sublevelu. Treba napomenuti paladijum, čiji je "jesen" dva elektrona: pd 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 4p 6 4d 10 5s 0. Druga vrsta izuzetaka iz pravila Clekkovsky je da se jedan elektron nalazi na 5D sublayeru prije punjenja 4F-suite: LA 1S 2 2s 2 2p 6 3s 2 3p 6 34 4S 2 4p 6 4d 10 4F 0 5S 2 5p 6 5D 1 6s 2. Sljedeći element (Cerium) 5D-sudes je pušten, a oba elektrona nalaze se na 4F-suitu: CE 1S 2 2s 2 2p 6 3s 2 3p 6 3D 10 4S 2 4p 6 4D 10 4F 2 5S 2 5p 6 5D 0 6S 2. Slično tome, u 7. razdoblju Actiniuma, potonje elektrona nalazi se na 6D pionir (a ne 5F, jer bi trebao biti prema pravilima Clekkovskyja).