Distribuce elektronů v multielektronické atomu je založena na principu minimální energie, principu V. papuliho, pravidlo F. Hundého a pravidla Klekkovského.
Princip minimální energie:
Elektron je primárně umístěn v elektronické podvrstvě s nejnižší energií.
Za prvé, orbitály jsou vyplněny, charakterizované nejmenší potenciální energií.
Princip Powli:
V atomu nemohou být dvě elektrony, ve kterých by všechna čtyři kvantová čísla byla stejná.
V důsledku toho může být každý orbital charakterizovaný určitými hodnotami n, ℓ a m ℓ obsazeno ne více než dvěma elektrony, jejichž zády mají opačné známky. Takové elektrony se nazývají parsen.
Pomocí principu Pauli můžete vypočítat, který maximální počet elektronů může být na každé úrovni a supers, tj. Určete úroveň kapacity a Sublevel.
Počet orbitálů na Sulevels je určen počtem možných hodnot magnetického kvantového čísla, tj 2ℓ + 1 hodnota. Vzhledem k tomu, že každá orbitálová (určitá hodnota kvantových čísel n, ℓ a m ℓ) může pojmout dvě elektrony s různými hodnotami spin, pak je maximální počet elektronů, které mohou být umístěny na tomto apartmá, je: 2 (2ℓ + 1). Maximální počet elektronů, které mohou být v dané úrovni, charakterizován hlavním kvantovým číslem n, rovnou 2N 2.
Hundové pravidlo:
V nejstabilnějším stavu atomu jsou elektrony umístěny v elektronické podvrakci tak, aby jejich celkový spin je maximum. M. Je symbol nablerononů, který může být na dané úrovni, vyznačující se hlavním kvantovým číslem
Například atom dusíku na vnější úrovni elektronů je dva a tři p-elektrony. Zde jsou elektrony v orbitálech znázorněny šipkami směřujícími nahoru nebo dolů v závislosti na znamení počtu kvantového odstředění. S-S-Believer obsahuje jediný orbitál, na kterých jsou dvě elektrony s opačným spinem v souladu s principem Pauli. V souladu s pravidlem HINA, minimální energie bude mít konfiguraci A, ve kterém budou na každé ze tří p-orbitálů jeden elektron se stejnými otočenými otočením, takže celkový odstředění bude maximalizována (± 3/2) a ne, ve kterém celkový točit méně (± 1/2):
První pravidlo Clakovsky:
Elektron má nejnižší energii na elektronickém Sublevelu, kde součet hlavních a orbitálních kvantových čísel je minimální.
E \u003d min s n + ℓ \u003d min
V souladu s prvním pravidlem Clekkovského se náplň podvrstvých elektronů vyskytuje v pořadí podvrstvá s minimální hodnotou množství (n + ℓ) na podvrstvé ve velkých hodnotách n + ℓ.
Pokud je součet (n + ℓ) stejný pro elektronické podněty podněcovány, se použije distribuce elektronů druhé pravidlo Clakovsky:
Electron má nejnižší energii na Sulevels s nejmenší hodnotou hlavního kvantového čísla.
4.5 Elektronická atomová struktura a periodický prvek
Na ℓ \u003d 0, tj. Na S-Supro je pouze jeden orbitál, který je obvykle znázorněn ve formě buňky. V atomu n je jediný elektron na nejnižších možných energetických stavech, tj. Na S-Supro měchy první elektronické vrstvy (na 1s-pion). Elektronická struktura Atomu N může být předložena režimem:
V atomu helia, jehož sekvenční číslo v periodickém systému (nebo jádr z) je 2, druhý elektron je také v 1S stavu. Elektronická struktura atomu helia:
Tento atom doplňuje výplň K-vrstvy nejblíže k jádru a je tedy dokončena konstrukce prvního období systému elementu.
Metody popisu elektronických mušlemi zvažovaných pro atomy H a on se nazývají elektron-grafické vzorce (orbitální obrazy jsou znázorněny ve formě buněk) a elektronické vzorce (linie jsou označeny písmeny a je indikován počet elektronů k nim horní index).
V následujícím hélii lithiového prvku (Z \u003d 3) již třetí elektron nemůže být umístěn na orbitální K-vrstvu. K-vrstva se nazývá první elektronickou vrstvu atomu.: To by odporovalo principem Pauliho. Proto zaujímá S-stav druhé úrovně energie (L-vrstva. L-vrstva se nazývá druhá elektronická vrstva atomu., N \u003d 2). Jeho elektronická struktura se zaznamenává 1S 2 2S 1 vzorec. Elektronická struktura následující beryllium a boron následuje to odpovídá vzorci 1s 2 2S 2 a 1S 2 2S 2 P 1, což odpovídá elektronovým grafickým vzorci v diagramu:
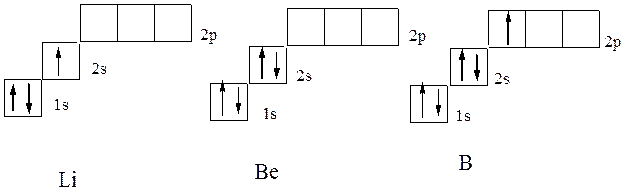
Zkrácená forma elektronické struktury atomu se používá. Současně je popsána struktura vnějších polotovarů a místo elektronické struktury vnitřních vrstev je symbol inertního plynu indikován v závorkách, jejichž elektronická struktura odpovídá zbývající části elektronického vzorce . Takže pro prvky druhého období je první elektronická úroveň (n \u003d 1) odpovídající atomu helia plně vyplněny. Elektronický vzorec ve zkrácené verzi atomů: Lithium - 2S 1, beryllium verze atomu atomu lithia: Takže pro prvky druhého období, elektronická struktura KOTO2S 2, Boron - 2S 2 2p 1.
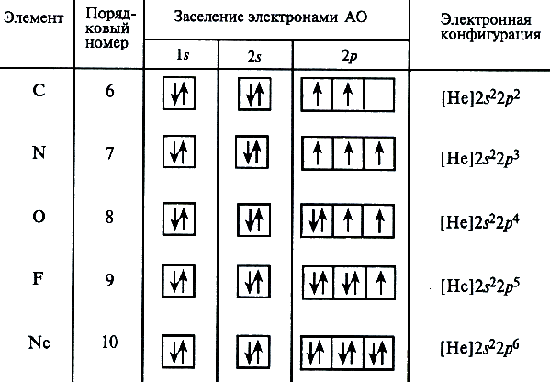
Pro atom uhlíku, tři možné schémata plnicí elektronové mušle mohou být již převzaty v souladu s elektronikou a grafickým vzorcem:
Analýza atomových spektra ukazuje, že toto schéma je správné. Tento postup pro umístění elektronů v atomu uhlíku představuje zvláštní případ obecného vzoru vyjádřený Hinda pravidlem: Stabilní stav atomu odpovídá takovému rozložení elektronů v rámci energetické podvrstvy, ve které absolutní hodnota celkového spin Atom je maximum. Elektronická struktura pro atom dusíku (Z \u003d 7) je uvedena výše.
Pak začíná páry elektronů na 2p orbitálech. Elektronické vzorce zbývajících atomů druhého období:
O 1S 2 2S 2 2P 4; F 1S 2 2S 2 2p 5; NE 1S 2 2S 2 2P 6
Neo atomový konec vyplnění druhé úrovně energie a výstavba druhého období systému prvků je dokončena.
Třetí období, podobně jako druhý, začíná dvěma prvky (Na, Mg), ve kterých jsou elektrony umístěny na S-pioningu vnější elektronické vrstvy. Tyto prvky se nazývají S-Elements. Mluvit jinak, patří k rodině S-Elements. (to znamená, že se týkají S-rodiny prvků). Poté se dodržují šest prvků (od AL k AR), které mají p-subableer externí elektronové vrstvy. Jedná se o atomy p-prvků (patří do p-rodiny). Struktura vnější elektronické vrstvy odpovídajících prvků druhé a třetí období je podobná. Jinými slovy, se zvýšením náboje jádra, elektronická struktura vnějších vrstev atomů se pravidelně opakuje. Elektronická struktura atomů však určuje vlastnosti prvků a jejich sloučenin. To je podstata periodického práva: vlastnosti prvků a je tvořených jejich jednoduchými a komplexními látkami jsou v periodické závislosti na náboji jádra.
Atom Argon zůstává neobsazený všemi orbitály 3D-Sublevels. Následující argonové prvky - draslík a vápník - náplň 3. elektronické vrstvy je dočasně zastaveno a 4. vrstva S-Su-vrstva začíná tvořit. Takový řád vyplnění vyplývá z prvního pravidla Clakovsky. V důsledku toho musí být 4S-Sublayer (N + ℓ \u003d 4) vyplněn dříve než 3D (n + ℓ \u003d 5). Pro atom Scandium vyvstává otázka: Který z podlepělů by měl být naplněn - 3D nebo 4P, protože Součet n + ℓ je pro ně stejná a rovna bodem 5. V takových případech je objednávka dokončení určena druhým pravidlem. První a druhá pravidla Clakovsky nejsou často rozděleny, ale jsou považovány za jedno společné pravidlo pravidla Clachkovsky, podle které jsou stejné množství částky (n + ℓ) vyplněny v pořadí zvýšení hlavního kvantového čísla n . Vyplnění 3D podvrstvy se vyskytuje v deseti prvcích z SC do Zn. Jedná se o atomy D-Elements. Pak začíná tvorba 4P-suite (P-prvky z GA do KR). Stejně jako atomy předcházejících vznešených plynů - neon a argon - atom kryptonu se vyznačuje strukturou vnější elektronické vrstvy NS 2 np 6.
Páté období je tvořeno podobně.
V šestém období, po naplnění, 6S podvozník začíná plnicí 4f-suite a jsou dodržovány atomy f-prvků. Vzhledem k tomu, že jejich vnější je šestá úroveň a elektrony důsledně zabírají 4. úroveň, která je mnohem blíže k jádru, chemické vlastnosti všech těchto F-prvků jsou blízko Lanthan, takže se často nazývají Lanthanoids ( V 7. období se f-prvky nazývají Actinoids). Po 4F, 5D je vyplněn a nakonec 6P podvrtávačný, který doplňuje výstavbu šestého období. Sedmý období není dokončeno, protože Prvky s velkým nábojem jádra jsou velmi nestabilní (jaderné reakce jsou snadno tekoucí).
Řád plnění Sulevel v souladu s pravidly Clakovského může být napsán jako sekvence: 1S → 2S → 2p → 3S → 3P → 4s → 3D → 4P → 5s → 4d → 5P → 6s → 4f → 5d → 6S → 7s → 5d → 6d → 7s → 5f → 6d → 7S. Nicméně, pro některé prvky, tato sekvence je rozbitá, tj. Od pravidel Clakovského existují výjimky. V ČR, Cu, Nb, Mo, RU, RH, Pd, Pd, Ag, PT, Au, existuje "selhání" elektronu s vnější vrstvou S-Su-su-supro-vrstva, která vede k energeticky více Stabilní stav atomu ve většině odpovídajících plně (Cu, Pd, AG, PT, AU) nebo polovina (ČR, MO) naplněné D-pomocným rámem. Elektronický vzorec atomu mědi má například formu: Cu 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4s 1, tj. Jeden ze dvou 4s elektronů "selže" na 3D-Sublevel. Mělo by být poznamenáno Palladium, jehož "pád" dvě elektrony: PD 1S 2 2S 2 2P 6 3S 2 3P 6 4s 2 4P 6 4d 10 5s 0. Druhý typ výjimek z Clekkovského pravidla je, že jeden elektron je umístěn na 5D podvrtávce před naplněním 4f-suite: LA 1S 2 2S 2 2P 6 3S 2 3P 6 34 4S 2 4P 6 4d 10 4f 0 5s 2 5p 6 5d 1 6s 2. Další prvek (cerium) 5D-Sudes je uvolněn a obě elektrony jsou umístěny na 4f-suite: CE 1S 2 2S 2 2P 6 3S 2 3P 6 3D 104S 2 4P 6 4d 10 4f 2 5s 2 5p 6 5d 0 6s 2. Podobně, v 7. období Actinia, druhý elektronů se nachází na 6D průkopníkovi (a ne 5F, protože by mělo být podle pravidel Clekkovského).