توزیع الکترونها در یک اتم چندگانه بر اساس اصل حداقل انرژی، اصل V. Papuli، حاکمیت F. Hund و حکومت Klekkovsky است.
اصل حداقل انرژی:
الکترون عمدتا درون زیرزمین الکترونیکی با کمترین انرژی قرار دارد.
اول، اوربیتال ها پر شده اند، که توسط کوچکترین انرژی بالقوه مشخص می شوند.
اصل Powli:
هیچ دو الکترون در اتم وجود ندارد، که در آن همه چهار عدد کوانتومی یکسان خواهند بود.
در نتیجه، هر مداری مشخص شده توسط مقادیر مشخصی از n، ℓ و m ℓ می تواند توسط بیش از دو الکترون اشغال شده است که پشت آن علائم مخالف است. چنین الکترونها Parsen نامیده می شود.
با استفاده از اصل Pauli، شما می توانید محاسبه کنید که حداکثر تعداد الکترون ها را می توان در هر سطح و فوق العاده، I.E. ظرفیت سطح و Subblevel را تعیین کنید.
تعدادی از اوربیتال ها بر روی Sublevels توسط تعداد مقادیر احتمالی تعداد کوانتومی مغناطیسی، I.E. مقدار 2ℓ + 1. از آنجایی که هر مداری (مقدار مشخصی از اعداد کوانتومی N، ℓ و M ℓ) می تواند دو الکترون را با مقادیر اسپین های مختلف جایگزین کند، سپس حداکثر تعداد الکترون هایی که می توانند در این مجموعه قرار داده شوند عبارتند از: 2 (2 ℓ + 1). حداکثر تعداد الکترون هایی که می توانند در یک سطح مشخص باشند، توسط تعداد کوانتومی اصلی N، برابر 2n 2 مشخص می شود.
حکم هانت:
در پایدارترین حالت اتم، الکترون ها درون زیرزمین الکترونیکی قرار می گیرند تا کل چرخش آنها حداکثر باشد. M. نماد نولررونون ها است که می تواند در سطح داده شده باشد، مشخص شده توسط تعداد کوانتومی اصلی
به عنوان مثال، یک اتم نیتروژن در سطح الکترون خارجی دو و سه الکترون الکترون است. در اینجا، الکترونها در اوربیتال ها توسط فلش \u200b\u200bبه سمت بالا یا پایین نشان داده شده است بسته به علامت تعداد کوانتومی اسپین. S-Believer شامل تنها مدار است که دو الکترون با چرخش های مخالف مطابق با اصل پائولی وجود دارد. مطابق با حاکمیت هندی، حداقل انرژی پیکربندی می کند، که در آن هر یک از سه p-orbitals یک الکترون با همان چرخش های هدایت شده است، بنابراین کل چرخش به حداکثر می رسد (± 3/2) ، و نه که در آن کل چرخش کمتر (± 1/2):
قانون اول Clakovsky:
الکترون دارای کمترین انرژی در Subblevel الکترونیک است، جایی که مجموع تعداد کوانتومی اصلی و مداری حداقل است.
e \u003d min با n + ℓ \u003d min
مطابق با اولین قاعده کلیکاوفسکی، پر کردن الکترونهای زیرزمینی به ترتیب زیرشاخه ها با حداقل مقدار مقدار (n + ℓ) به زیرشاخه ها در مقادیر زیادی از n + ℓ رخ می دهد.
اگر مبلغ (n + ℓ) برای زیرمجموعه های الکترونیکی مورد توجه قرار گیرد، با توزیع الکترونها استفاده می شود قانون دوم Clakovsky:
الکترون دارای کمترین انرژی در زیرمجموعه ها با کوچکترین مقدار تعداد کوانتومی اصلی است.
4.5 ساختار اتمی الکترونیکی و سیستم عنصر دوره ای
در ℓ \u003d 0، I.E. در S-Supro، تنها یک مدار وجود دارد که معمولا به شکل یک سلول نشان داده شده است. در اتم N، تنها الکترون تنها در کمترین حالت انرژی ممکن است، I.E. بر روی S-supro supro از اولین لایه الکترونیکی (بر روی 1s-pion). ساختار الکترونیکی اتم N می تواند توسط طرح ارائه شود:
در اتم هلیوم، تعداد توالی که در سیستم دوره ای (یا هسته Z) 2 است، الکترون دوم نیز در حالت 1S است. ساختار الکترونیکی اتم هلیوم:
این اتم تکمیل پر کردن K لایه نزدیکترین به هسته را تکمیل می کند و بنابراین ساخت اولین دوره سیستم عنصر تکمیل شده است.
روش های توصیف پوسته های الکترونیکی در نظر گرفته شده برای اتم های H و او فرمول های الکترونی-گرافیک نامیده می شود (تصاویر مدار به شکل سلول ها نشان داده شده است) و فرمول های الکترونیکی (خطوط با حروف نشان داده می شود و تعداد الکترون ها به آنها نشان داده شده است توسط شاخص بالا).
در هلیم زیر عنصر لیتیوم (z \u003d 3)، الکترون سوم دیگر نمی تواند در لایه K Orbital قرار گیرد. K-Layer اولین لایه الکترونیکی اتم نامیده می شود. این با اصل پائولی مخالف است. بنابراین، این وضعیت S-STALL STALLE سطح انرژی دوم را اشغال می کند (L-Layer. L-Layer لایه دوم اتم الکترونیکی، n \u003d 2) نامیده می شود. ساختار الکترونیکی آن توسط 1S 2 2S 1 فرمول ثبت شده است. ساختار الکترونیکی بریلیوم و بور زیر به دنبال آن است که به فرمول 1S 2 2 2S 2 و 1S 2 2S 2 P 1 مربوط می شود که مربوط به فرمول های گرافیکی الکترونی در نمودار است:
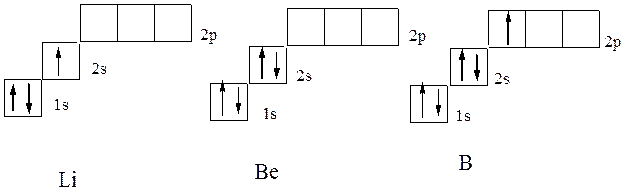
فرم اختصاری ساختار الکترونیکی اتم استفاده می شود. در عین حال، ساختار سطوح خالی خارجی توصیف شده است، و به جای ساختار الکترونیکی لایه های داخلی، نماد گاز بی اثر در براکت ها نشان داده شده است، ساختار الکترونیکی که مربوط به بخش باقی مانده از فرمول الکترونیکی است . بنابراین، برای عناصر دوره دوم، اولین سطح الکترونیکی (n \u003d 1) مربوط به اتم هلیوم به طور کامل پر شده است. فرمول الکترونیکی در نسخه اختصاری اتم ها: لیتیوم - 2S 1، نسخه بریلیوم اتم اتم لیتیوم: بنابراین برای عناصر دوره دوم، ساختار الکترونیکی Koto2s 2، بور - 2S 2 2P 1.
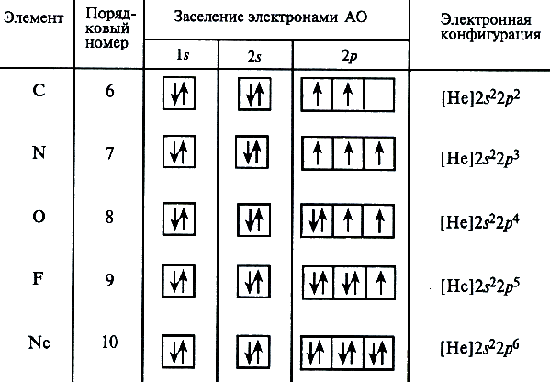
برای اتم کربن، سه طرح احتمالی پر کردن پوسته های الکترومغناطیسی می تواند مطابق با الکترونیک و فرمول های گرافیکی فرض شود:
تجزیه و تحلیل طیف اتمی نشان می دهد که طرح دوم درست است. این روش برای قرار دادن الکترونها در اتم کربن، یک مورد خاص از یک الگوی کلی بیان شده توسط قاعده هندی را نشان می دهد: حالت پایدار اتم مربوط به چنین توزیع الکترون های درون زیرمجموعه انرژی است که در آن ارزش مطلق کل چرخش است از اتم حداکثر است. ساختار الکترونیکی اتم نیتروژن (Z \u003d 7) بالا ارائه شده است.
سپس جفت الکترون ها بر روی اوربیتال های 2P آغاز می شود. فرمول های الکترونیکی اتم های باقی مانده از دوره دوم:
O 1S 2 2 2S 2 2P 4؛ F 1S 2 2 2S 2 2P 5؛ NE 1S 2 2S 2 2P 6
اتم NEO پایان دادن به سطح انرژی دوم، و ساخت دوره دوم سیستم عناصر تکمیل شده است.
دوره سوم، شبیه به دوم، با دو عنصر (Na، Mg) آغاز می شود، که در آن الکترون ها بر روی S-pionery از لایه بیرونی الکترونیکی قرار می گیرند. چنین عناصری S-lements نامیده می شود. صحبت کردن متفاوت، آنها متعلق به خانواده S-Elements هستند. (به عنوان مثال، آنها به خانواده S-Familes مربوط می شوند). سپس شش عنصر (از AL TO AR) دنبال می شوند، که دارای یک زیر واحد یک لایه الکترون خارجی هستند. این اتم های P-lements (متعلق به خانواده P) است. ساختار لایه بیرونی الکترونیکی عناصر مربوطه دوره های دوم و سوم مشابه است. به عبارت دیگر، با افزایش شارژ هسته، ساختار الکترونیکی لایه های بیرونی اتم ها به صورت دوره ای تکرار می شود. با این حال، ساختار الکترونیکی اتم ها خواص عناصر و ترکیبات آنها را تعیین می کند. این ماهیت قانون دوره ای است: خواص عناصر و آنها تشکیل شده توسط آنها مواد ساده و پیچیده در وابستگی دوره ای به اتهام هسته است.
اتم Argon باقی می ماند توسط همه Orbitals 3D-subblevels باقی می ماند. با این حال، عناصر آرگون زیر - پتاسیم و کلسیم - پر کردن لایه سوم الکترونیکی به طور موقت متوقف می شود و لایه چهارم S-Su-Layer شروع می شود. چنین نظمی از پر کردن از قانون اول کلوکوفسکی پیروی می کند. در نتیجه، 4S-sublayer (n + ℓ \u003d 4) باید قبل از 3D پر شود (n + ℓ \u003d 5). برای اتم اسکاندیم، این سوال مطرح می شود: کدام یک از زیرمجموعه ها باید پر شود - 3D یا 4P، زیرا مجموع N + ℓ برای آنها یکسان است و برابر 5. در چنین مواردی، سفارش تکمیل توسط قانون دوم تعیین می شود. قوانین اول و دوم Clakovsky اغلب تقسیم نمی شوند، اما به عنوان یک قاعده مشترک قانون Clachkovsky در نظر گرفته می شود، که بر اساس آن مقدار مشابهی از مقدار (N + ℓ) به منظور افزایش تعداد کوانتومی اصلی، پر شده است . پر کردن یک زیرساخت 3D در ده عنصر از SC به Zn رخ می دهد. این اتمهای عناصر D هستند. سپس تشکیل 4P-suite شروع می شود (عناصر P از GA به KR). و همچنین اتمهای گازهای نجیب قبلی - نئون و آرگون - اتم کریپتون توسط ساختار لایه بیرونی الکترونیکی NS 2 NS 6 مشخص می شود.
دوره پنجم به طور مشابه شکل گرفته است.
در دوره ششم، پس از پر کردن، زیرپوشای 6S، 4F-suite را پر می کند و اتم های عناصر F دنبال می شود. با توجه به این واقعیت که خارجی آنها سطح ششم است و الکترونها به طور مداوم سطح چهارم را اشغال می کنند، که بسیار نزدیک به هسته است، خواص شیمیایی همه این عناصر F نزدیک به لانتان هستند، به طوری که آنها اغلب به نام لانتانوئید ها نامیده می شوند ( در 7th دوره F-lements actinoids نامیده می شود). پس از 4F، 5D پر شده است و در نهایت، زیرپوشانی 6P، که ساخت دوره ششم را تکمیل می کند. دوره هفتم کامل نشده است، زیرا عناصر با شارژ زیادی از هسته بسیار ناپایدار هستند (واکنش های هسته ای به راحتی جریان می یابند).
منظور پر کردن مشعل مطابق با قوانین Clakovsky را می توان به عنوان یک دنباله نوشته شده است: 1S → 2S → 2P → 3S → 3P → 4S → 3D → 4P → 5S → 4D → 5P → 6S → 4F → 5D → 6P → 7S → 5F → 6D → 7P. با این حال، برای برخی از عناصر، این توالی شکسته است، به عنوان مثال از قوانین Clakovsky استثنائات وجود دارد. در CR، Cu، Nb، Mo، Ru، Rh، PD، AG، PT، اتم های Au، یک "شکست" یک الکترون با یک لایه خارجی S-supro Beer در D-supro وجود دارد به طور کامل (Cu، Pd، Ag، Pt، Au) یا نیمی (Cr، Mo) پر شده با D-subframe. به عنوان مثال، فرمول الکترونیکی اتم مس دارای فرم است: Cu 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 1، I.E. یکی از دو الکترون 4S "نتواند" در 3D-subblevel شکست بخورد. این باید توسط پالادیوم اشاره شود که "پاییز" دو الکترون است: PD 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 4P 6 4D 10 5S 0. دومین نوع استثناء از قانون Clekkovsky این است که یک الکترون در زیر لامپ 5D قبل از پر کردن 4F-suite قرار دارد: la 1s 2 2 2s 2 2P 6 3S 2 3P 6 34 4S 2 4P 6 4D 10 4F 0 5S 2 5P 6 5D 1 6S 2. عنصر بعدی (سریم) 5d-sudes منتشر شده است، و هر دو الکترون در 4F-Suite قرار دارند: CE 1S 2 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 6 4D 10 4F 2 5S 2 5P 6 5D 0 6S 2 به طور مشابه، در دوره 7 actinium، دومی از الکترونها در پیشگام 6D (و نه 5F قرار دارد، زیرا باید بر اساس قوانین Clekkovsky باشد).