Dystrybucja elektronów w atomie multielektronicznym opiera się na zasadę minimalnej energii, zasady V. Papuli, zasady F. Hund i zasadę Klekkovsky.
Zasada minimalnej energii:
Elektron znajduje się przede wszystkim w elektronicznym podmuchu z najniższą energią.
Po pierwsze, orbitały są wypełnione, charakteryzującymi się najmniejszą energią potencjalną.
Zasada Powli:
W atomu nie może być dwóch elektronów, w których wszystkie cztery liczby kwantowe byłyby takie same.
W związku z tym każda orbitalizacja charakteryzuje się pewnymi wartościami N, ℓ i M ℓ może być zajęty przez nie więcej niż dwie elektrony, których plecy mają przeciwne znaki. Takie elektrony nazywane są parsen.
Korzystając z zasady Pauli, możesz obliczyć, która maksymalna liczba elektronów może być na każdym poziomie i supers, tj. Określ pojemność poziomu i SULEVEL.
Liczba orbitałów na Sublevels jest określona przez liczbę możliwych wartości magnetycznego numeru kwantowego, tj. 2ℓ + 1 wartość. Ponieważ każda orbital (pewna wartość liczb kwantowych N, ℓ i m ℓ) może pomieścić dwa elektrony o różnych wartościach wirowania, a następnie maksymalna liczba elektronów, które można umieścić na tym pakiecie: 2 (2ℓ + 1). Maksymalna liczba elektronów, które mogą być na danym poziomie, charakteryzuje się główną liczbą kwantową N, równą 2N 2.
Zasada Hund:
W najbardziej stabilnym stanie atomu elektrony są umieszczane w elektronicznej sublayer, dzięki czemu ich całkowity spin jest maksymalny. M. jest symbolem Nablerononów, który może być na danym poziomie, charakteryzującym się głównym numerem kwantowym
Na przykład, atom azotu na zewnętrznym poziomie elektronu wynosi dwa i trzy elektrony p. Tutaj elektrony w orbitały są przedstawiane przez strzałki skierowane w górę lub w dół w zależności od znaku numeru kwantowego wirowania. S-Seliever zawiera jedyny orbital, na którym znajdują się dwie elektrony z przeciwległych spinów zgodnie z zasadą Pauli. Zgodnie z zasadą Hindy, minimum energii będzie miała konfigurację A, w której na każdym z trzech z orbitałów Pa będzie jednym elektronem z tymi samymi skierowanymi spinami, więc całkowity spin zostanie zmaksymalizowany (± 3/2) i nie, w którym całkowity spinowy mniej (± 1/2):
Pierwsza reguła Clakovsky:
Elektron ma najniższą energię na elektronicznym Suglevel, gdzie suma głównej i orbitalnej liczby kwantowej jest minimalna.
E \u003d min z n + ℓ \u003d min
Zgodnie z pierwszą zasadą Clekkovsky wypełnienie elektronów Subleer występuje w kolejności podmoratorów z minimalną wartością kwoty (N + ℓ) do podnośników w dużych wartościach N + ℓ.
Jeśli suma (N + ℓ) jest taka sama dla rozważanych badań elektronicznych, przy użyciu rozkładu elektronów druga reguła Clakovsky:
Elektron ma najniższą energię na suplivels z najmniejszą wartością głównego numeru kwantowego.
4.5 Elektroniczna struktura atomowa i system okresowy
W ℓ \u003d 0, tj. Na S-SUPRO znajduje się tylko jedna orbitalna, która jest zwykle przedstawiona w formie komórki. W N ATOM, jedyny elektron jest w najniższych możliwych stanach energii, tj. W S-SUPRO mieszek pierwszej warstwy elektronicznej (na 1S-pion). Elektroniczna struktura atomu N można przesyłać przez schemat:
W atomie helu, której liczba w układzie okresowym (lub jądro z) wynosi 2, drugi elektron jest również w stanie 1S. Elektroniczna struktura atomu helu:
Ten atom wypełnia wypełnienie najbliżej jądra Kernela, a zatem zakończono budowę pierwszego okresu systemu elementu.
Metody opisywania skorup elektronicznych rozważanych w przypadku atomów H i nazywane są formuły elektron-graficzne (obrazy orbitalne są przedstawione w postaci komórek) i elektronicznych wzorów (linie są oznaczone literami, a wskazana jest liczba elektronów do nich. przez górny indeks).
W następnym helu elementu litu (Z \u003d 3) trzeci elektron nie może być już umieszczony na orbitalnej warstwie K. K-warstwy nazywany jest pierwszą warstwą elektroniczną atomem.: Zapaliłoby to zasady Pauli. Dlatego zajmuje to stan drugiego poziomu energii (warstwa L. L-warstwa Lazuje się drugą warstwą elektroniczną atomem., N \u003d 2). Jego struktura elektroniczna jest rejestrowana przez formułę 1S 2 2S 1. Elektroniczna struktura następującego berylu i boru następuje, odpowiada wzorze 1S 2 2S 2 i 1S 2 2S 2 p 1, co odpowiada formułach graficznych elektronów na diagramie:
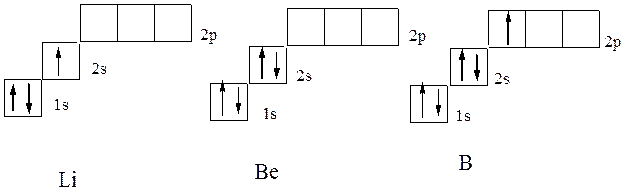
Używa się skróconej formy elektronicznej struktury atomu. Jednocześnie opisano strukturę zewnętrznych poziomów pustych, a zamiast struktury elektronicznej warstw wewnętrznych, symbol gazu obojętnego jest wskazywany w nawiasach, którego struktura elektroniczna odpowiada pozostałej części formuły elektronicznej . Tak więc, dla elementów drugiego okresu, pierwszy poziom elektroniczny (N \u003d 1) odpowiadający atomowi helu jest w pełni wypełniony. Elektroniczna formuła w skróconej wersji atomów: litu - 2S 1, beryl wersja atomu atomu litowego: więc dla elementów drugiego okresu, struktura elektroniczna Koto2s 2, Boron - 2 2P 1.
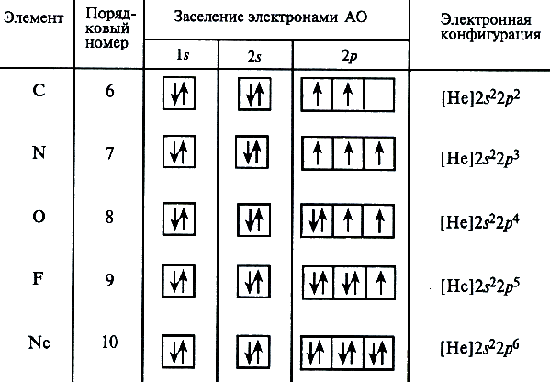
W przypadku atomu węgla trzech możliwych schematów wypełnień powłoki elektronów można już założyć zgodnie z elektroniką i formułami graficznymi:
Analiza widma atomowego pokazuje, że ten ostatni schemat jest poprawny. Ta procedura umieszczenia elektronów w atomie węgla stanowi specjalny przypadek ogólnego wzoru wyrażonego przez zasadę hindą: stabilny stan atomu odpowiada takiej rozkładu elektronów w podmokłach energii, w której bezwzględna wartość całkowitego spin atomu jest maksymalny. Przedstawiona jest struktura elektroniczna atomu azotu (Z \u003d 7).
Następnie rozpoczynają się pary elektronów na orbitytach 2P. Elektroniczne wzory pozostałych atomów drugiego okresu:
O 1S 2 2S 2 2P 4; F 1S 2 2S 2 2P 5; NE 1S 2 2S 2 2P 6
Neo Atom kończy się wypełnienie drugiego poziomu energii, a konstrukcja drugiego okresu systemu elementów jest zakończona.
Trzeci okres, podobny do drugiego, zaczyna się od dwóch elementów (NA, Mg), w których elektrony są umieszczane na S-Pionery zewnętrznej warstwy elektronicznej. Takie elementy nazywane są elementami S. Mówiąc inaczej, należą do rodziny elementów S. (tj. Odnoszą się do rodziny S). Następnie przestrzegano sześciu elementów (od Al do AR), który ma P-subayer zewnętrznej warstwy elektronowej. Są to atomy elementów p (należą do rodziny p). Struktura zewnętrznej warstwy elektronicznej odpowiednich elementów drugiego i trzeciego okresów jest podobna. Innymi słowy, wraz ze wzrostem ładunku jądra, struktura elektroniczna warstw zewnętrznych atomów jest okresowo powtarzana. Jednak struktura elektroniczna atomów określa właściwości elementów i ich związków. Jest to istota okresowego prawa: właściwości elementów i ich utworzone przez nich proste i złożone substancje są w okresowej zależności od opłaty jądra.
Atom Argon pozostaje niezamężny przez wszystkie orbitale 3D-SUBLEVELS. Jednakże, następujące elementy argonu - potas i wapń - napełnianie trzeciej warstwy elektronicznej jest tymczasowo zatrzymane, a czwarta warstwę S-SU rozpoczyna formularz. Taka kolejność wypełnienia wynika z pierwszej reguły trzpienia. W konsekwencji, 4S-Subaraer (N + ℓ \u003d 4) należy wypełnić wcześniej niż 3D (N + ℓ \u003d 5). W przypadku atomu skandum pojawia się pytanie: Które z samionów powinny być wypełnione - 3D lub 4P, ponieważ Suma N + ℓ jest taka sama dla nich i równa 5. W takich przypadkach zamówienie ukończenia jest określane przez drugą zasadę. Pierwsze i drugie zasady trzonów często nie są podzielone, ale są uważane za jedną wspólną zasadę reguły Clachkovsky, zgodnie z którym wypełniono te same ilości kwoty (N + ℓ), w kolejności zwiększenia głównej liczby kwantowej n . Wypełnienie Subbareera 3D występuje w dziesięciu elementach z SC do Zn. Są to atomy D-Elements. Wtedy rozpoczyna się tworzenie 4P-pakietu (P-Elements z GA do KR). Jak również atomy poprzednich gazów szlachetnych - Neon i Argon - atom Crypton charakteryzuje się strukturą zewnętrznej warstwy elektronicznej NS 2 NP 6.
Piąty okres jest formowany podobnie.
W szóstym okresie, po wypełnieniu, 6S Subaraer rozpoczyna napełnianie 4F-suite, a następnie nastąpiły atomy elementów f. Ze względu na fakt, że ich zewnętrzny jest szósty poziom, a elektrony konsekwentnie zajmują 4 poziom, co znacznie bliżej jądra, właściwości chemiczne wszystkich tych elementów f znajdują się w pobliżu Lanthana, więc często nazywają się lantanami ( W 7. Okres F-Elements nazywane są aktinoidami). Po 4F, 5D jest wypełniony i wreszcie, 6P Subleer, który uzupełnia budowę szóstego okresu. Siódmy okres nie jest ukończony, ponieważ Elementy o dużym ładunku jądra są bardzo niestabilne (reakcje jądrowe łatwo płynące).
Kolejność wypełniania Sublevel zgodnie z zasadami Clakovsky może być napisana jako sekwencja: 1s → 2s → 2P → 3S → 3P → 4S → 3D → 4P → 5s → 4D → 5P → 6S → 4F → 5D → 6 p → 7s → 5F → 6D → 7P. Jednak dla niektórych elementów ta sekwencja jest uszkodzona, tj. Z zasad Clakovsky są wyjątki. W CR, Cu, NB, MO, RU, RH, PD, AG, PT, AU AU atomów, istnieje "awaria" elektronu z warstwą zewnętrzną warstwą S-Supro, która prowadzi do energetycznie więcej Stabilny stan atomu w większości odpowiednich w pełni (Cu, PD, AG, PT, AU) lub połowę (CR, MO) wypełnione podramką D. Na przykład elektroniczny wzór atomu miedzi ma formularz: Cu 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4s 1, tj. Jeden z dwóch 4S elektronów "nie powiedzie się" na 3d-Sublevel. Należy zauważyć, że pallad, którego "upadku" dwa elektrony: PD 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 4P 6 4D 10 5S 0. Drugim rodzajem wyjątków z zasady Clekkovsky jest taki, że jeden elektron znajduje się na Subararze 5D przed napełnieniem 4F-Suite: La 1S 2 2S 2 2P 6 3S 2 3P 6 34 4S 2 4P 6 4D 10 4F 0 5S 2 5P 6 5d 1 6s 2. Następny element (CERIUR) 5D-Sudes jest zwolniony, a obie elektrony znajdują się na 4F-Suite: CE 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 6 4D 10 4F 2 5S 2 5P 6 5D 06 2. Podobnie, w 7. okresie aktynu, drugi elektronów znajduje się na pionierem 6D (a nie 5F, ponieważ powinno być zgodnie z zasadami Clekkovsky).